电导率与电解质浓度的关系
电解质溶液的电导率及摩尔电导率均随溶液的浓度变化而变化,但强、弱电解质的变化规律却不尽相同。几种不同的强弱电解质其电导率 χ 与摩尔电导率 Λm 随浓度的变化关系示于图1和图2。
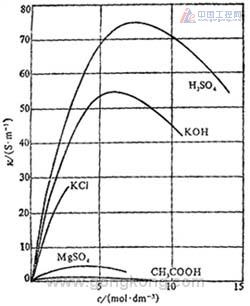
图1
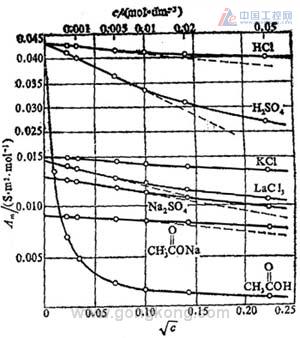
图2
从图1可以看出,对强电解质来说,在浓度不是很大时,χ 随浓度增大而明显增大。这是因为单位体积溶液中导电粒子数增多的原故。当浓度超过某值之后,由于正、负离子间相互作用力增大,而由此造成的导电能力减小大于导电粒子增多而引起的导电能力增大,故净结果是 χ 随浓度增大而下降。所以在电导率与浓度的关系曲线上可能会出现最高点。弱电解质溶液的电导率随浓度的变化不显著,这是因为浓度增加电离度随之减少,所以溶液中离子数目变化不大。
与电导率不同,无论是强电解质或弱电解质,溶液的摩尔电导率 Λm 均随浓度的增加而减小(见图2)。但二者的变化规律不同。
对强电解质来说,在水溶液中可视为百分之百电离,因此,能导电的离子数已经给定。当浓度降低时,离子之间的相互作用力随之减弱,正、负离子的运动速度因此增加,故 Λm 增大。当浓度降低到一定程度、离子之间作用力已降到极限,此时摩尔电导率趋于一极限值——无限稀释时的摩尔电导率 Λm∞。在浓度较低的范围内,Λm,Λm∞ 与浓度 C 之间存在着下列经验关系式:
式中 A 为一常数。
但对弱电解质来说,溶液变稀时离解度增大,致使参加导电的离子数目大为增加(注意:电解质数量未变),因此 Λm 的数值随浓度的降低而显著增大。当溶液无限稀释时,电解质已达 100% 电离,且离子间距离很大,相互作用力可以忽略。因此,弱电解质溶液在低浓度区的稀释过程中。Λm 的变化比较剧烈且 Λm 与 Λm∞ 相差甚远,Λm 与 C 之间也不存在上式所示的关系。
在线ph计|在线酸度计|在线ph检测仪|工业酸度计|在线ph计生产厂家